LIMS per il Controllo Qualità
Collegamenti LabPro AC e euGMP Annex 11 , FDA CFR Title 21 Part 11
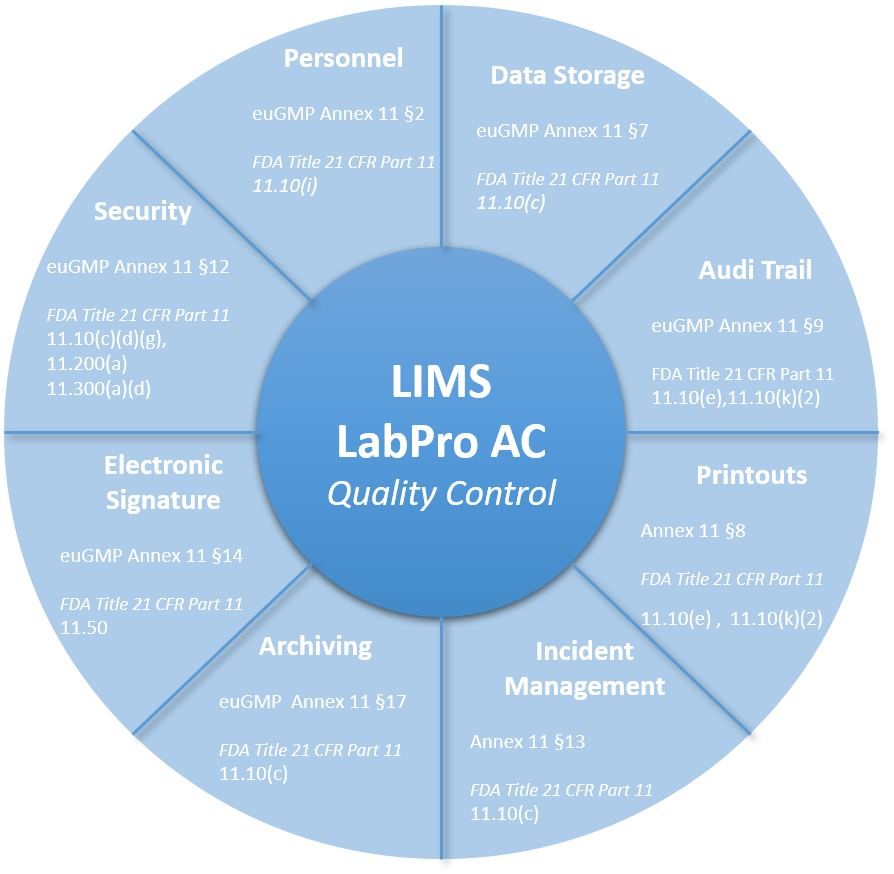
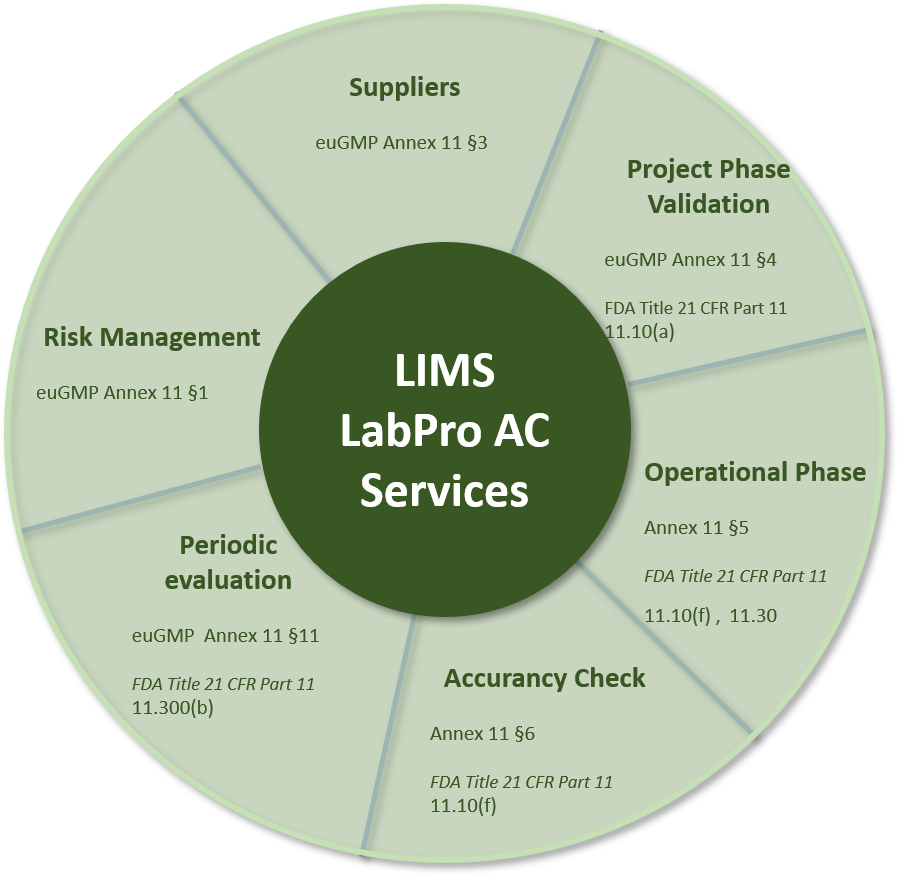
LabPro AC LIMS GMP Matrix
Come il Nostro LIMS rispetta i requisiti euGMP Annex 11 e FDA CFR Title 21 Part 11
Annex 11 §1 Risk Management (Gestione dei rischi)
EU GMP Annex 11
Risk management should be applied throughout the lifecycle of the computerised system taking into account patient safety, data integrity and product quality. As part of a risk management system, decisions on the extent of validation and data integrity controls should be based on a justified and documented risk assessment of the computerised system.
LABPRO LIMS
Mettiamo a disposizione dei nostri clienti il servizio di “Verifiche periodiche per testare, verificare e valutare l'efficacia delle misure tecniche e organizzative al fine di garantire la sicurezza del trattamento ai sensi dell’art. 32 punto 1 lettera d) del GDPR 2016/679 nell’ambito dell’utilizzo del software LIMS LabPro AC”.
Tale servizio consiste nella verifica documentata dei seguenti aspetti, richiesti anche dalla normativa sopra richiamata (GDPR):
Esecuzione del c.d. “Disaster recovery” attestante la capacità di ripristinare tempestivamente la disponibilità e l'accesso dei dati personali in caso di incidente fisico o tecnico. (Regolamento UE 2016/679) punto 32)
Annex 11 §2 Personnel (Personale)
EU GMP Annex 11
There should be close cooperation between all relevant personnel such as Process Owner, System Owner, Qualified Persons and IT. All personnel should have appropriate qualifications, level of access and defined responsibilities to carry out their assigned duties.
LABPRO LIMS
Mettiamo a disposizione dei nostri clienti corsi di formazione specifici sui vari moduli del prodotto, sia in fase di start-up che successivamente all’acquisto di eventuali funzionalità aggiuntive o richieste di approfondimenti, con rilascio di attestato di partecipazione. Sempre nell’ottica di fornire un servizio orientato alla formazione continua, manuteniamo e rendiamo disponibile un dettagliato HELP in linea accessibile via web. L’accesso all’applicativo è preceduto da una richiesta di utente e password. La gestione degli utenti che accedono all'applicativo ha implicazioni in varie fasi del software, in particolare: possono essere impostate delle restrizioni di accesso alle funzionalità dell'applicativo in relazione alle autorizzazioni alle varie funzioni organizzative previste dal laboratorio. Ad esempio, il personale addetto all'accettazione dei campioni potrebbe non poter accedere all'inserimento dei risultati delle prove, oppure il personale addetto all'emissione dell'ordine di acquisto di materiale potrebbe aver inibita la funzione di registrazione e controllo delle fatture dei fornitori. Le funzioni "tecniche" di laboratorio (stampa dei fogli di lavoro e inserimento risultati) possono essere vincolate all'appartenenza del personale tecnico ad una specifica area di laboratorio; ad esempio, il personale addetto all'inserimento dei risultati delle prove di microbiologia potrebbe avere preclusa la possibilità di inserire i risultati delle prove chimiche.
Annex 11 §3 Suppliers and Service Providers (Fornitori)
EU GMP Annex 11
3.1 When third parties (e.g. suppliers, service providers) are used e.g. to provide, install, configure, integrate, validate, maintain (e.g. via remote access), modify or retain a computerised system or related service or for data processing, formal agreements must exist between the manufacturer and any third parties, and these agreements should include clear statements of the responsibilities of the third party. IT-departments should be considered analogous. 3.2 The competence and reliability of a supplier are key factors when selecting a product or service provider. The need for an audit should be based on a risk assessment. 3.3 Documentation supplied with commercial off-the-shelf products should be reviewed by regulated users to check that user requirements are fulfilled. 3.4 Quality system and audit information relating to suppliers or developers of software and implemented systems should be made available to inspectors on request.
LABPRO LIMS
L’accordo formale consiste in un contratto tra le parti. Si riporta di seguito un estratto del contratto: 3.1 Il servizio di assistenza/supporto consiste nella disponibilità di tecnici specializzati ogni qualvolta si presenti una richiesta scritta, telefonica o via e-mail da parte di un utilizzatore accreditato o comunque dal Cliente, per chiarimenti sull’uso delle funzioni e per la risoluzione degli eventuali problemi tecnico-funzionali riguardanti il software sviluppato da PROACTIVE sas per i quali il cliente ha sottoscritto l’assistenza 3.2 Il servizio viene erogato nella modalità di
- Teleassistenza (accesso remoto alla postazione del cliente che richiede assistenza), fornita tramite il software TeamViewer ®, che garantisce la massima sicurezza in materia di accessi al sistema non autorizzati 1 . Per maggiori informazioni in merito si visiti il sito internet www.teamviewer.com/it. Il Cliente per permettere l’accesso al sistema al tecnico PROACTIVE sas dovrà attivare la teleassistenza sulla sua postazione di lavoro. Senza tale attivazione il tecnico PROACTIVE sas non può in alcun modo accedere alla postazione di lavoro del cliente. Il cliente può verificare costantemente l’attività del tecnico PROACTIVE sas sul proprio monitor. Il cliente può, in qualsiasi momento, interrompere la connessione remota.
- A mezzo mail
- Telefonica
Annex 11 §4 Project Phase – Validation
EU GMP Annex 11
4.1 The validation documentation and reports should cover the relevant steps of the life cycle. Manufacturers should be able to justify their standards, protocols, acceptance criteria, procedures and records based on their risk assessment. 4.2 Validation documentation should include change control records (if applicable) and reports on any deviations observed during the validation process. 4.3 An up to date listing of all relevant systems and their GMP functionality (inventory) should be available. For critical systems an up to date system description detailing the physical and logical arrangements, data flows and interfaces with other systems or processes, any hardware and software pre-requisites, and security measures should be available. 4.4 User Requirements Specifications should describe the required functions of the computerised system and be based on documented risk assessment and GMP impact. User requirements should be traceable throughout the life-cycle. 4.5 The regulated user should take all reasonable steps, to ensure that the system has been developed in accordance with an appropriate quality management system. The supplier should be assessed appropriately. 4.6 For the validation of bespoke or customised computerised systems there should be a process in place that ensures the formal assessment and reporting of quality and performance measures for all the life-cycle stages of the system. 4.7 Evidence of appropriate test methods and test scenarios should be demonstrated. Particularly, system (process) parameter limits, data limits and error handling should be considered. Automated testing tools and test environments should have documented assessments for their adequacy. 4.8 If data are transferred to another data format or system, validation should include checks that data are not altered in value and/or meaning during this migration process.
LABPRO LIMS
Configurazione del software La configurazione del software che precede la sua installazione viene documentata dalla Schede Parametrizzazione (MO.INS.01) che viene inviata al cliente. La scheda descrive per ogni modulo del software il significato dei vari parametri disponibili per la configurazione, il valore inserito per ogni parametro e se questo rappresenti la configurazione standard o sia la conseguenza di una URS (User Requirement Specification). Modifiche di software commerciale.
- Le modifiche/personalizzazioni richieste (es,. report, query e statistiche) sono effettuate solo a fronte di richiesta documentata del cliente (Modello MO.ASS.01); a seguito dell’installazione della personalizzazione richiesta la stessa viene sottoposta a validazione del cliente. Tale validazione può essere effettuata, su richiesta del cliente, anche in ambiente di test.
- L’aggiornamento del prodotto ad una nuova release viene sottoposto ai test di validazione del produttore; solo a seguito di esito positivo l’applicativo aggiornato viene installato in ambiente di test de cliente che può pertanto sottoporlo ai propri test di validazione. L’installazione dell’aggiornamento in ambiente effettivo viene sottoposto ai test previsti dal Rapporto di verifica corretta installazione (IQ/OQ Report).
Annex 11 §5 Operational Phase – Data
EU GMP Annex 11
Computerised systems exchanging data electronically with other systems should include appropriate built-in checks for the correct and secure entry and processing of data, in order to minimize the risks.
LABPRO LIMS
Le procedure realizzate per scambiare elettronicamente dati con altri sistemi prevedono sempre controlli integrati che permettono di validare il dato prima che questo venga esportato/importato sul sistema esterno. Tali controlli sono realizzati sulla base di specifiche di interfacciamento tra i sistemi. Ad esempio, l’export delle fatture elettroniche prevede la validazione con uno schema XSD fornito dall’agenzia delle entrate. Nell’import dei risultati da strumento è implementata una pre-importazione dei dati che abbina automaticamente il barcode importato con quello presente del database ed è possibile impostare dei criteri di accettabilità che permettono di selezionare automaticamente i risultati corretti in base ai criteri definiti. Infine l’utente abilitato può verificare, validare e quindi autorizzare l’import.
Annex 11 §6 Accuracy Checks
EU GMP Annex 11
For critical data entered manually, there should be an additional check on the accuracy of the data. This check may be done by a second operator or by validated electronic means. The criticality and the potential consequences of erroneous or incorrectly entered data to a system should be covered by risk management.
LABPRO LIMS
Il LIMS prevede una serie di controlli e warning (che possono parametricamente essere resi bloccanti) relativi ai vari punti dello specifico processo. A titolo di esempio non esaustivo ne riportiamo alcuni:
- Processo di validazione a più livelli prima dell’emissione dei rapporti di prove
- Possibilità di rendere parametricamente obbligatori campi in accettazione e inserimento risultati
- Segnalazione fuori tolleranza durante l’inserimento dei risultati in base ai valori di riferimento inseriti Validazione obbligatoria delle formule prima dell’utilizzo con audit trail delle modifiche apportate alle stesse.
Annex 11 §7 Data Storage
EU GMP Annex 11
7.1 Data should be secured by both physical and electronic means against damage. Stored data should be checked for accessibility, readability and accuracy. Access to data should be ensured throughout the retention period. 7.2 Regular back-ups of all relevant data should be done. Integrity and accuracy of backup data and the ability to restore the data should be checked during validation and monitored periodically.
LABPRO LIMS
Il LIMS prevede esecuzione di copie di backup schedulate con tempistiche concordate con il cliente. Sarà cura del cliente effettuare copie di sicurezza su supporti esterni. Come servizio aggiuntivo viene offerto come attività periodica “Disaster recovery” che permette di garantire l’integrità e l’accuratezza dei backup.
Annex 11 §8 Printouts
EU GMP Annex 11
8.1 It should be possible to obtain clear printed copies of electronically stored data. 8.2 For records supporting batch release it should be possible to generate printouts indicating if any of the data has been changed since the original entry.
LABPRO LIMS
Qualsiasi documento è esportabile nei formati più comuni: PDF, Excel, testo, Word, csv e conseguentemente ottenere stampe cartacee dei dati salvati elettronicamente.
Annex 11 §9 Audit Trails
EU GMP Annex 11
Consideration should be given, based on a risk assessment, to building into the system the creation of a record of all GMP-relevant changes and deletions (a system generated "audit trail"). For change or deletion of GMP-relevant data the reason should be documented. Audit trails need to be available and convertible to a generally intelligible form and regularly reviewed.
LABPRO LIMS
Le registrazioni tecniche relative alle modifiche/ eliminazione dei campioni/analisi sono tracciate ed è possibile esportare e visualizzare il log dell’audit trail per mostrare data, ora e utente e azione effettuata.
Annex 11 §10 Change and Configuration Management
EU GMP Annex 11
Any changes to a computerised system including system configurations should only be made in a controlled manner in accordance with a defined procedure.
LABPRO LIMS
Modifiche di software commerciale.
- Le modifiche/personalizzazioni richieste (es,. report, query e statistiche) sono effettuate solo a fronte di richiesta documentata del cliente (Modello MO.ASS.01); a seguito dell’installazione della personalizzazione richiesta la stessa viene sottoposta a validazione del cliente. Tale validazione può essere effettuata, su richiesta del cliente, anche in ambiente di test.
- L’aggiornamento del prodotto ad una nuova release viene sottoposto ai test di validazione del produttore (Unit test, test di integrazione) ; solo a seguito di esito positivo l’applicativo aggiornato viene installato in ambiente di test del cliente che può pertanto sottoporlo ai propri test di validazione. L’installazione dell’aggiornamento in ambiente effettivo viene sottoposto ai test previsti dal Rapporto di verifica corretta installazione (IQ/OQ Report)
Annex 11 §11 Periodic evaluation
EU GMP Annex 11
Computerised systems should be periodically evaluated to confirm that they remain in a valid state and are compliant with GMP. Such evaluations should include, where appropriate, the current range of functionality, deviation records, incidents, problems, upgrade history, performance, reliability, security and validation status reports.
LABPRO LIMS
Per la registrazione dei guasti del sistema e delle appropriate azioni immediate e correttive, il LIMS mette a disposizione una sezione dedicata alle non conformità/azioni correttive. Per quanto riguarda le apparecchiature e gli strumenti di laboratorio, il LIMS prevede uno specifico modulo per generare rapporti di intervento con registrazione delle misurazioni e degli esiti.
Annex 11 §12 Security
EU GMP Annex 11
12.1 Physical and/or logical controls should be in place to restrict access to computerised system to authorised persons. Suitable methods of preventing unauthorised entry to the system may include the use of keys, pass cards, personal codes with passwords, biometrics, restricted access to computer equipment and data storage areas. 12.2 The extent of security controls depends on the criticality of the computerised system. 12.3 Creation, change, and cancellation of access authorisations should be recorded. 12.4 Management systems for data and for documents should be designed to record the identity of operators entering, changing, confirming or deleting data including date and time.
LABPRO LIMS
È previsto l’accesso al sistema tramite l’utilizzo di utente e password complessa e con scadenza. Ogni accesso al programma, autorizzato o non, viene registrato ed è visibile nel menu “Log Accessi”.
Annex 11 §13 Incident Management
EU GMP Annex 11
All incidents, not only system failures and data errors, should be reported and assessed. The root cause of a critical incident should be identified and should form the basis of corrective and preventive actions.
LABPRO LIMS
Si veda punto 11.
Annex 11 §14 Electronic Signature
EU GMP Annex 11
Electronic records may be signed electronically. Electronic signatures are expected to:
- have the same impact as hand-written signatures within the boundaries of the company,
- be permanently linked to their respective record,
- include the time and date that they were applied.
LABPRO LIMS
Si veda punto 15.
Annex 11 §15 Batch Release
EU GMP Annex 11
When a computerised system is used for recording certification and batch release, the system should allow only Qualified Persons to certify the release of the batches and it should clearly identify and record the person releasing or certifying the batches. This should be performed using an electronic signature.
LABPRO LIMS
Il LIMS prevede la possibilità di generare i Rapporti di Prova in formato pdf al momento della stampa degli stessi; i files generati potranno essere firmati digitalmente (firma digitale elettronica CADES/PADES) sia con Aruba Key (prodotto e distribuito da Aruba PEC S.p.A.) che con altri software di firma digitale. I files firmati digitalmente verranno archiviati automaticamente nelle directory previste nelle configurazioni del programma. In generale tutti i documenti prodotti dal software sono esportabili come PDF e quindi firmabili digitalmente.
Annex 11 §16 Business Continuity
EU GMP Annex 11
For the availability of computerised systems supporting critical processes, provisions should be made to ensure continuity of support for those processes in the event of a system breakdown (e.g. a manual or alternative system). The time required to bring the alternative arrangements into use should be based on risk and appropriate for a particular system and the business process it supports. These arrangements should be adequately documented and tested.
LABPRO LIMS
Eventuali soluzioni per prevenire gli effetti di guasti, come ad esempio le rido0ndanze e le tecniche di virtualizzazione sono a carico del Cliente. Offriamo il nostro supporto per un eventuale ripristino e/o riattivazione delle licenze del LIMS.
Annex 11 §17 Archiving
EU GMP Annex 11
Data may be archived. This data should be checked for accessibility, readability and integrity. If relevant changes are to be made to the system (e.g. computer equipment or programs), then the ability to retrieve the data should be ensured and tested.
LABPRO LIMS
Il database relazionale Microsoft SQL server utilizzato dal LIMS garantisce l’accessibilità e l’integrità dei dati. Nel caso in cui il cliente effettui un upgrade del hardware o sostituzioni di server/postazioni lavoro, il nostro servizio prevede la migrazione /reinstallazione sul nuovo parco macchine. A seguito dell’intervento verrà rilasciata la nuova documentazione aggiornata. Su richiesta del cliente può essere effettuata un’archiviazione su un ambiente separato (STORICO) con eliminazione dei dati dall’ambiente in linea. L’ambiente storico rimane accessibile e funzionante.
